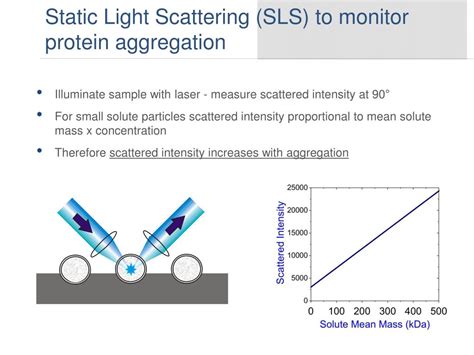
Dalam industri bioteknologi, sinkronisasi dan pencegahan agregasi protein adalah sangat penting. Agregat protein dapat terbentuk selama produksi, formulasi, penyimpanan, pengiriman, dan lain-lain akibat tekanan fisika dan kimia (misalnya, fluktuasi suhu, perubahan pH, oksidasi, guling, dsb.). Agregasi protein juga dapat terjadi karena struktur lipida protein yang tidak benar, yang cenderung memiliki patch hidrofofik eksternal.
Dalam artikel ini, kita akan membahas penggunaan dinamika sinaran cahaya (Dynamic Light Scattering, DLS) sebagai alat analisis proses untuk sinkronisasi dan pencegahan agregasi protein. DLS adalah metode yang menggunakan sinar cahaya untuk mengukur ukuran partikel yang kecil hingga besar.
Penggunaan DLS dalam Sinkronisasi Protein
Dalam penelitian ini, kita menggunakan albumin serum sapi (Bovine Serum Albumin, BSA) sebagai model protein monomernya. Albumin adalah protein yang terdiri atas tiga domain homologous (I, II, dan III). Kami menggunakan DLS untuk mengukur radius hidrodinamik (rH) BSA pada konsentrasi urea berbeda.
Hasil penelitian menunjukkan bahwa rH BSA memiliki korelasi positif dengan konsentrasi urea. Pada 0 dan 4 M urea, rH BSA diukur sebesar 3,8 dan 6,2 nm dengan DLS. Hasil ini sesuai dengan data gel filtration yang dilaporkan.
Penggunaan DLS dalam Sinkronisasi Protein
Dalam industri farmasi, kualitas produk obat biasanya ditunjukkan oleh serangkaian tes laboratorium yang dilakukan setelah produksi selesai. Namun, ini tidak efektif dan tidak efisien karena waktu siklus produksi panjang dan tingkat keluar-batasan tinggi. Jika batch terblok, biasanya terlambat untuk membuat perubahan.
Untuk menangani masalah ini, FDA Amerika Serikat meluncurkan inisiatif PAT (Process Analytical Technology) pada tahun 2000. DLS dapat digunakan sebagai metode PAT at-line untuk mengurangi variabilitas proses dan memastikan kualitas produk.
Kesimpulan
Dalam penelitian ini, kita berhasil mengembangkan metode DLS berbasis untuk sinkronisasi in-process IB solubilization, protein refolding, dan agregasi. Dengan menggunakan protein SP1 sebagai contoh, kami menunjukkan bahwa radius hidrodinamik yang diukur dengan DLS akurat mewakili kandungan agregat dan keadaan pengfolding protein. Metode ini memiliki potensi untuk digunakan sebagai PAT at-line untuk mengurangi variabilitas proses dan memastikan kualitas produk.
Kredit
Pengarang ingin mengucapkan terima kasih kepada Dr. Marina Kirkitadze dan timnya di R&D Analytical, Sanofi Pasteur, yang memberikan analisis SEC-MALS.
Referensi
[1] Expression, purification, and refolding of the recombinant extracellular domain β
Tautan Sumber
[51] Dinamika sinaran cahaya sebagai alat analisis proses. Scopus
Copyright © 2013 Wiley Periodicals, Inc. and the American Pharmacists Association. Published by Elsevier Inc. All rights reserved.