Dalam bab ini, kita akan membahas tentang Model Atomik Rutherford yang dikemukakan oleh Ernest Rutherford, seorang ilmuwan Britania. Sebelumnya, J.J. Thomson telah mengembangkan model "plum pudding" yang tidak dapat menjelaskan hasil eksperimen terkait struktur atomik unsur-unsur. Dalam artikel ini, kita akan membahas tentang eksperimen Alpha Scattering Rutherford, observasi dari eksperimen tersebut, Model Atomik Rutherford, serta batasannya.
Rutherfords Alpha Scattering Experiment
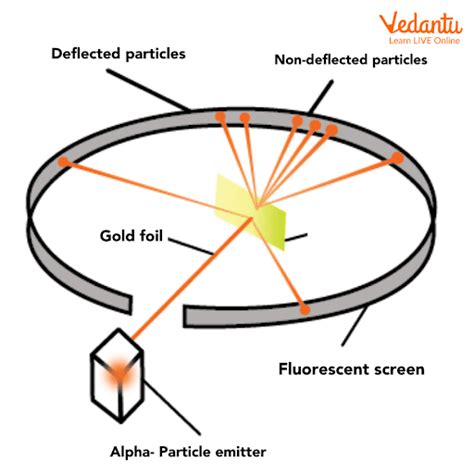
Rutherford mengadakan eksperimen dengan bombardir tipis lembaran emas dengan partikel α dan kemudian mempelajari lintasan partikel-partikel setelah interaksi mereka dengan lembaran emas. Dalam eksperimen ini, Rutherford menggunakan sumber radioaktif untuk menghasilkan aliran energi tinggi dari partikel α.
Observations of Rutherford’s Alpha Scattering Experiment
Dengan melakukan eksperimen tersebut, Rutherford membuat beberapa observasi yang kontradiksi dengan model atomik Thomson. Observasinya menunjukkan bahwa:
- Sebagian besar partikel α yang bombardir terhadap lembaran emas tidak mengalami defleksi sama sekali dan sebagian besar ruang dalam suatu atom adalah kosong.
- Beberapa partikel α disela oleh lembaran emas dengan sudut kecil, sehingga charge positif dalam suatu atom tidak berdistibusikan secara merata. Charge positif dalam suatu atom terkonsentrasi dalam volume sangat kecil.
- Sedikitnya partikel α yang disela kembali, yaitu hanya beberapa partikel α yang memiliki sudut defleksi sekitar 180 derajat. Oleh karena itu, volume yang diisi oleh partikel-partikel positif dalam suatu atom sangat kecil dibandingkan dengan volume total suatu atom.
Rutherford Atomic Model
Berdasarkan observasi dan kesimpulan tersebut, Rutherford mengembangkan struktur atomik unsur-unsur. Menurut model atomik Rutherford:
- Charge positif dan sebagian besar massa suatu atom terkonsentrasi dalam volume sangat kecil. Dia menamai wilayah ini sebagai inti.
- Model Rutherford juga mengklaim bahwa partikel-partikel negatif (elektron) yang melingkupi inti, berputar di sekitar inti dengan kecepatan sangat tinggi dalam jalur lingkaran. Dia menamai jalur-jalur tersebut sebagai orbit.
- Elektrostatic force attraction kuat antara partikel-partikel negatif dan inti mempertahankan adanya atom.
Limitations of Rutherford Atomic Model
Meskipun model atomik Rutherford berbasis pada observasi eksperimen, ia tidak dapat menjelaskan beberapa hal. Salah satu kekurangan adalah bahwa Rutherford tidak mengatakan apapun tentang penempatan partikel-partikel negatif dalam suatu atom, sehingga teori ini tidak lengkap.
Model Rutherford juga tidak dapat menjelaskan stabilitas atom, seperti yang dikemukakan Maxwell bahwa partikel-partikel yang bergerak akan menghasilkan radiasi elektromagnetik dan membawa energi dari gerakannya. Hal ini seharusnya membuat partikel-partikel negatif jatuh ke dalam inti.
Video Rekomendasi
- The Gold Foil Experiment
- Structure of Atom Class 11 Chemistry
Frequently Asked Questions – FAQs
Q1: Apa yang istimewanya model atomik Rutherford?
A1: Rutherford adalah yang pertama menentukan adanya inti dalam suatu atom. Ia melakukan eksperimen bombardir partikel α pada lembaran emas, yang memungkinkannya untuk menemui adanya spesies positif di dalam atom.
Q2: Apa model atomik Rutherford?
A2: Model atomik Rutherford menjelaskan bahwa charge positif dan sebagian besar massa suatu atom terkonsentrasi di inti. Ia juga mengklaim bahwa partikel-partikel negatif berputar di sekitar inti dengan kecepatan sangat tinggi dan terdapat force attraction antara mereka.
Q3: Apa batasannya model atomik Rutherford?
A3: Model atomik Rutherford tidak dapat menjelaskan penempatan partikel-partikel negatif dalam suatu atom. Selain itu, ia juga tidak dapat menjelaskan stabilitas atom.
Q4: Apa jenis eksperimen yang dilakukan Rutherford?
A4: Rutherford melakukan eksperimen Alpha Scattering.
Q5: Apa observasi utama model atomik Rutherford?
A5: Observasi utama model atomik Rutherford adalah bahwa suatu partikel mikroskopis positif terkonsentrasi di dalam inti, dan sebagian besar massa suatu atom terkonsentrasi di inti.